La medicina del trabajo predictiva: un nuevo escenario
Introducción
Los nuevos avances en el ámbito de la genómica están despertando un creciente interés por lo que podríamos denominar medicina personalizada. Siguiendo a Guttmacher, el conocimiento basado en la genómica y las herramientas que nos brinda nos va a permitir acercar nos a cada paciente como la individualidad biológica que es, lo que cambiará radicalmente nuestros paradigmas e incrementará nuestra eficacia. La propia Organización Mundial de la Salud (OMS) ha recalcado que la
investigación en medicina genómica es estratégica para las naciones: el 21 de enero de 2004, en la 113 sesión de la OMS, se hizo pública la Resolución EB 113/13 sobre Genómica y Salud Mundial.
La medicina personalizada ha sido siempre un componente de las buenas prácticas médicas. Recordemos el célebre método de la silla del Dr. Gregorio Marañón, un ejemplo de individualización del acto médico; en definitiva, los tests genéticos nos pueden dotar de nuevas herramientas, pero no deben cambiar el objetivo fundamental de ayudar al paciente en la curación o en el alivio de su dolencia.
Sin embargo, la medicina del trabajo cuenta, a su vez, con la singularidad de conocer el medio que rodea al trabajador, por lo que el concepto de susceptibilidad en esta especialidad excede al de otras, al ser la resultante de la carga genética y de los factores externos condicionantes.
Estos factores posiblemente no modifiquen el genoma, pero sí pueden condicionar el proceso de transcripción y el de síntesis proteica. En definitiva, estos factores externos, en nuestro ámbito laboral, pueden interactuar con los niveles transcriptómico y proteómico (Figura 1).
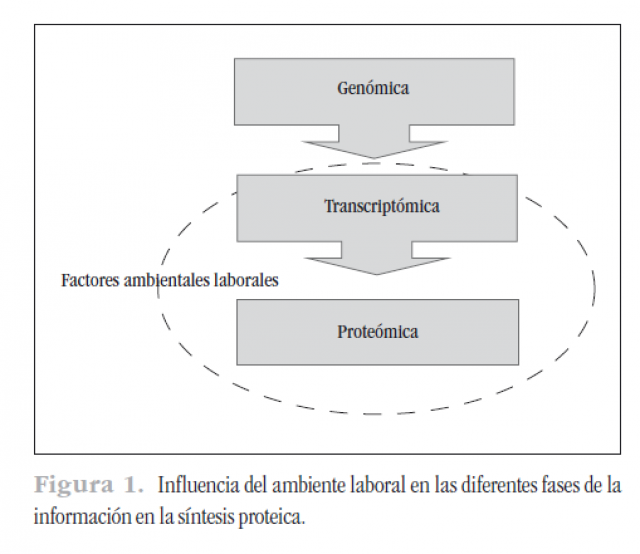
Todo esto va a permitir al médico del trabajo efectuar una prevención y un consejo sanitario basados en la carga genética del individuo. En un futuro podremos conocer la susceptibilidad a padecer determinada enfermedad y el modo en que el medio laboral puede afectar al trabajador.
Jean Dausset, Premio Nobel de Medicina, define la medicina predictiva como “la identificación de individuos sanos que tienen predisposición a desarrollar una determinada enfermedad”.
Antecedentes históricos
El inicio del Proyecto Genoma Humano comenzó su andadura en el año 1986 en la localidad de Santa Fe, en Nuevo México, donde se acordó secuenciar los 3.200 millones de nucleótidos del genoma humano de los que, como es sabido, existen 4 tipos: adenina, timina, citosina y guanina. En el año 1990 se consolidó el proyecto con tres objetivos fundamentales:
- 1.Generar los mapas de los cromosomas humanos.
- 2. Desarrollar un soporte técnico para la expresión de los genes.
- 3.Divulgar, por último, la información generada.
El principal hallazgo del Proyecto Genoma Humano consistió en conseguir la secuencia de los 3.200 millones de nucleótidos, el mapa que ubica a los cerca de 23.000 genes y el análisis de los cerca de 1.400 genes que se piensa pueden generar enfermedad. Se comprobó que los seres humanos compartimos el 99,9% de la secuencia. El 0,1% es propiedad de cada individuo. Las variaciones más habituales se producen cuando se cambia un solo nucleótido (o letra “A”, “T”, “C” o “G”), conocido popularmente por sus siglas en inglés SNP (single nucleotide polimorphisms). Estas variaciones se encuentran en un promedio de 1 cada 1.000-1.500 nucleótidos y hasta el momento se han identificado cerca de 10 millones de estas variaciones (por ejemplo, algunas personas pueden tener una “T” en una posición donde otros tienen una “G”) (Figura 2).
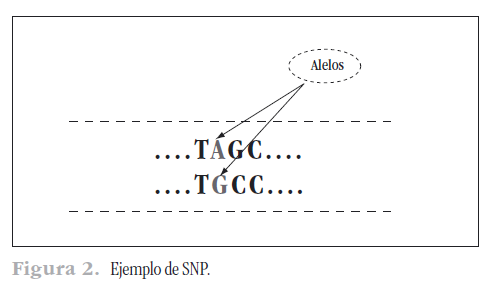
El número casi infinito de variaciones da lugar a la individualidad biológica y, en un porcentaje elevado, también a la psicológica. Sabemos que cada persona tiene dos copias de cada cromosoma (excepto los sexuales), y el conjunto de alelos es lo que conocemos como genotipo.
El análisis de los genes no ha sido sencillo históricamente. En la actualidad, la técnica conocida como microarrays permite analizar miles de genes en un único acto. El microarray consiste en un soporte en el que se han añadido fragmentos de genes, oligonucleótidos (fragmentos cortos de ADN) o productos procedentes de PCR. Al ponerse en contacto con material de la persona, permite identificar, gracias a la complementariedad, los genes presentes.
En ocasiones, los SNP se encuentran muy cercanos unos de otros y pueden heredarse de forma conjunta, siempre que no sean interrumpidos por una combinación. Estas variaciones, que se encuentran ligadas unas a otras, se llaman haplotipos y se transmiten de generación en generación ligadas al cromosoma donde asienten.
En el proyecto internacional HapMap, que inició su andadura en el año 2002, y tuvo como finalidad la elaboración de un mapa de bloques de haplotipos, y finalizó en el año 2005, se analizaron un millón de SNP. Este hecho es importante, ya que es la base para identificar factores genéticos asociados a determinadas enfermedades.
Sirva como ejemplo la asociación de determinados SNP con el gen que codifica el factor H del complemento (proteína que interviene en los procesos de inflamación) con la degeneración macular asociada a la edad.
Escribe tu comentario